红色诺卡氏菌细胞壁骨架通过刺激FPR3增强树突状细胞介导的Th1分化来激活宫颈组织的免疫反应
郭浅妤1, 陈炜1, 孙均意1, 赵春芳1, 白雪2, 张亚楠1, 刘珂1, 张雷1*, 邵素霞 1*
1河北医科大学组织学与胚胎学教研室,石家庄
2河北医科大学第四医院妇科,石家庄,中国
关键词:人乳头瘤病毒 (HPV) 1 、宫颈上皮内瘤变(CIN) 2 、免疫疗法3 、树突状细胞(DC) 4 、Th1 细胞极化5 、甲酰肽受体 3 (FPR 3) 6
摘要
红色诺卡氏菌细胞壁骨架(Nr-CWS)已被证明是治疗宫颈人乳头瘤病毒感染的成功药物。 Nr-CWS 的作用机制尚不清楚,但可能涉及对宿主免疫系统的刺激作用。我们之前发现,在 Nr-CWS 治疗后,宫颈组织中的 CD4 + T 细胞增加。来自这些宫颈组织的微阵列数据 揭示了甲酰化肽受体 3 (FPR3) 的显着上调。本研究旨在基于这些发现探讨 Nr-CWS 在免疫调节中的作用。对接受 Nr-CWS 治疗的患者宫颈组织中的CD4+ T细胞亚群进行检查,发现 Th1 细胞因子和转录因子显着增加。与传统的 DC 成熟诱导剂脂多糖 (LPS) 相比,评估了 Nr-CWS 对树突状细胞 (DC) 功能和表型的调节作用。与 LPS 类似,Nr-CWS 可有效诱导 DC 成熟和白细胞介素 12 (IL-12) 分泌。使用混合淋巴细胞反应测定评估由 Nr-CWS 刺激的 DC 诱导的 T 细胞分化。对 Th1 的显着分化是显而易见的。最后,测量了响应 Nr-CWS 和 LPS 的 DC 中的 FPR3 表达。 Nr-CWS 有效上调 FPR3 表达,而 LPS 则没有。在 DC 中沉默 FPR3 减少了 Nr-CWS 诱导的 IL-12 产生和共培养 T 细胞中的 Th1 细胞极化。这些研究结果表明,Nr-CWS可能针对DC细胞表面的FPR3并激活Th1型免疫反应。这些发现表明了Nr-CWS对人乳头瘤病毒的抗病毒免疫作用的基础。
简介
宫颈癌是发展中国家妇女死亡的主要原因[1] 。 高危型人乳头瘤病毒 (HR-HPV) 的持续感染是几乎所有宫颈癌和癌前病变的原因[2] 。疫苗的可用性和细胞学筛查逐渐降低了宫颈癌的发病率。然而,长期持续性HPV感染的清除仍是癌前病变综合治疗的核心难题。
CD4 + T 细胞包含一组细胞亚型,包括辅助性 T 细胞(Th1、Th2、Th17)和调节性 T 细胞 (Treg)。这些细胞对于介导 HPV 感染至关重要[3, 4] 。以分泌干扰素-γ (IFN-γ) 和白细胞介素-2 ( IL-2) 为特征的 Th1 型炎症反应是 HPV 清除所必需的[5] 。相反,Th2 型炎症反应通过免疫抑制导致持续性 HPV 感染和宫颈发育不良发展,其特征是产生 IL-4 和 IL-10 [6 ] 。 Th17细胞分泌IL-17,IL-17与宫颈病变的进展呈正相关[7] 。 HPV 募集的 Treg 具有免疫抑制作用。与消退的上皮病变相反,随着宫颈病变的进展,宫颈组织中 Treg 细胞(Foxp3 阳性细胞)的浸润增加 [8-10] 。
红色诺卡氏菌细胞壁骨架 (Nr-CWS) 已用于治疗鳞状上皮内病变,可有效消退病变和清除 HPV 感染[11] 。 Nr-CWS 可能通过直接激活 CD4 +和 CD8 + T 细胞免疫反应而具有免疫调节作用[12, 13] 。我们之前的研究发现,使用 Nr-CWS 进行局部治疗会增加宫颈组织中CD4 + T 细胞的数量[14] 。然而,Th1 型免疫反应是否在局部增强仍不清楚。
抗原呈递细胞是先天性和适应性免疫系统的桥梁。树突状细胞(DCs)控制着幼稚的CD4+ T细胞的命运,对诱导抗病毒免疫反应至关重要。 [15].抗原刺激导致DCs的成熟,其特点是HLA-DR、CD80、CD83和CD86的表达增加。 [16-18].最近,有人提出,Nr-CWS促进了DCs的增殖和生存能力。 [19].Zhang等人报道,Nr-CWS能促进DCs的成熟 [20].基于这些发现,我们探讨了T细胞对Nr-CWS刺激的DCs的反应。
我们未发表的微阵列数据显示,在Nr-CWS有效清除HPV的患者的宫颈组织中,甲酰化肽受体3(FPR3)明显上调。FPR3是FPR家族的一个成员。该蛋白通过检测标志着细菌存在的病原体相关分子模式,在免疫系统对感染的初步识别中发挥了关键功能。 [21].FPR3只在单核细胞和DC中表达,并且很少有配体被发现。 [22].作为最近发现的成员之一,FPR3的整体功能仍有待确定。据报道,FPR3是LPS诱导的DC成熟和T细胞激活的负调控因子。 [23]并参与敏化脂蛋白介导的Th2细胞分化。 [24].
在本研究中,探讨了Nr-CWS对DC诱导的T细胞分化在体内和体外的影响。评估了FPR3在这个过程中的作用。
材料和方法
2.1 患者
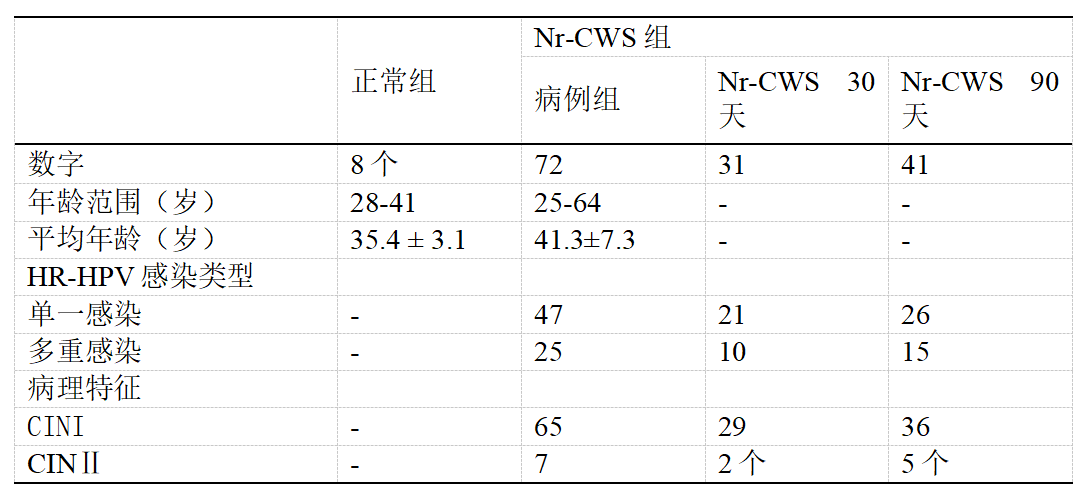
2019年至2021年,从河北医科大学第四医院妇科招募了72名年龄在25至64岁之间(平均41.3±7.3岁)的HR-HPV感染和组织学异常的患者。排除了孕妇和患有严重的心、肺、肝、肾疾病、其他肿瘤性疾病、免疫功能低下状态以及接受任何抗炎或免疫抑制治疗的患者。如前所述 [14]所有患者都接受了Nr-CWS的充分治疗。简而言之,治疗包括在一个月经周期内隔天在宫颈处局部应用120μg Nr-CWS,共10次。所有应用均由专科医生进行。在局部使用Nr-CWS之前(病例组)、30天(Nr-CWS 30D组)或90天(Nr-CWS 90D组)收集宫颈组织样本。
正常宫颈样本采集自 HPV 阴性患者(正常组,n=8,年龄范围 28-41 岁,平均35.4 ± 3.1 岁),他们因子宫肌瘤接受了完全子宫切除术。手术前未服用任何药物。所有病例均经组织学证实。
本研究得到了河北医科大学第四医院伦理委员会的批准(2019MEC097)。所有患者都获得了书面知情同意书。该研究符合《赫尔辛基宣言》的规定。
2.2 免疫组织化学染色(IHC)
将组织固定在4%的缓冲福尔马林中,用EDTA去鳞,嵌入石蜡中,并进行切片。将厚度为5μm的切片与下列主要抗体(每种抗体的稀释度为1:400)孵育过夜:IFN-γ (Cat#: DF-6045; Affinity Biosciences, USA); IL-4 (Cat#: AF-5142; Affinity Biosciences), IL-17a (Cat#: ab79056; Abcam, USA), Foxp3 (Cat#: ab215206; Abcam) 和转化生长因子-β (TGF-β, Cat#: CY2179; Abways Technology, USA) 。与辣根过氧化物酶偶联的聚合二级抗体(ZsBio,中国)和3,3'-二氨基联苯胺(DAB)用于可视化抗体结合。免疫组化分析按照以前的描述进行 [14].
2.3 RNA分离和PCR
用于 PCR 的组织样本在分离后在液氮中快速冷冻,并储存在 -80 °C 直至使用。从组织中分离的总 RNA 使用 RNAprep pure Micro Kit (Cat#: DP420; Tiangen, China) 使用 带有基因组 DNA 擦除器的 PrimeScript™ RT 试剂盒(目录号:RR047A; T aKaRa Bio,日本)。定量PCR 由 QuantStudio3 (Applied Biosystems, USA)执行 TB Green® Premix Ex Taq™ II(货号:RR820B; T aKaRa Bio ) 根据制造商的说明。 β-肌动蛋白用作管家基因。通过2 -ΔΔCT方法计算基因表达。引物序列列于表 1。
2.4 细胞制备
2.4.1 DC
使用先前描述的方法稍作修改获得 DC [25] 。根据当地血库的指南,来自河北省血液中心(中国石家庄)的匿名献血者的白细胞减少系统(LRS)室。本次收购获得河北医科大学批准。人单核细胞衍生的 DC 来源于从 LRS 室获得的外周血单核细胞 (PBMC ) 。将 DC 与 30 ng/ml 重组人粒细胞-巨噬细胞集落刺激因子 (rhGM-CSF)(目录号:30003;Peprotech,美国)和 30 ng/ml rhIL-4(目录号:20004;Peprotech)一起培养,用于5天。将 DC 分为三组:用磷酸盐缓冲盐水处理的细胞(未成熟 DC [iDC] 组),用 30 μg/ml Nr-CWS(辽宁格瑞泰斯特生物制药有限公司,中国)处理的细胞(Nr-CWS组),并用 100 ng/ml脂多糖(LPS,目录号:L4516,Sigma-Aldrich,美国)处理细胞2 天( LPS组)。收集培养基用于细胞因子分析,并通过流式细胞术分析细胞。
2.4.2 T细胞
使用人类CD4+ Naïve T细胞分离试剂盒(Cat#: 480042; BioLegend, USA)从PBMCs中分离出Naïve CD4+ T细胞。
2.4.3 共培养实验
进行 DC 和 T 细胞共培养的混合淋巴细胞反应 (MLR),以检查 DC 刺激 T 细胞的能力。 DC(每孔 1×10 5 个细胞)和同种异体幼稚 CD4 + T 细胞(每孔 1×10 6 个细胞)共培养 3 天,收集培养基用于细胞因子分析。将 HeLa 细胞以每孔5×10 4 个细胞的密度接种到 3 μm Falcon Transwell® 膜(美国康宁)上。当细胞生长达到 80% 融合时,DC 和 T 细胞在培养板的下室共培养 2 天。细胞培养过程如图 1 所示。 2A.
2.5 流式细胞术
在Nr-CWS或LPS处理2天后,将DC洗净,离心,并重新悬浮在200微升PBS中,其中含有1:40的CD83(Cat#: 305327; BioLegend)、CD86(Cat#: 305405; BioLegend)、HLA-DR(Cat#:307603; BioLegend)和FPR3(Cat#: ab172908; Abcam)的抗体稀释液。在4℃下孵育至少1小时后,清洗细胞并重新悬浮于PBS缓冲液中。使用BD Accuri C6流式细胞仪(BD Biosciences,美国)进行流式细胞仪分析。数据由FlowJo v10软件(FlowJo,美国)进行分析。
2.6 扫描电子显微镜(SEM )
为 SEM 准备了 DC 和 MLR 共培养物。细胞在 2.5% 戊二醛缓冲液中固定 30 分钟,然后通过酒精梯度脱水。完全风干后,将样品涂上金颗粒,并用 8100 型显微镜(Regulus,日本)进行观察。
2.7 小干扰RNA(siRNA)转染
siRNA购自GenePharma(中国)。序列为:si-FPR3,5'-GCCAUCCUACCAUUCCGAATT-3'和si-scrambled:5'-uucuccgaacgucacgutt-3'。在DC培养的第1天和第3天,根据制造商的说明,使用转染试剂Ultra Fection 3.0(Cat#: FXP135; 4A Biotech, China)对siRNA进行转染,终浓度为20nM。在第5天,收获DCs并用于进一步的实验。
2.8 酶联免疫吸附试验(ELISA)
根据制造商的说明,从细胞培养物中收集的培养基用于细胞因子的 ELISA 分析( Abclonal,中国)。在 DC 培养的第 7 天收集细胞上清液并分析IL -12p70(货号:RK00014)和 IL-10(货号:RK00012)。 MLR 2 天后收集 DC 和幼稚 CD4 + T 细胞共培养物的细胞上清液,并分析 IL-2(货号:RK00002)、IFN-γ(货号:RK00015)、IL-4(货号: : RK00003)、TGF-β(货号:RK00055)和 IL-17a(货号:RK00397)。
2.9 CCK-8细胞增殖检测
通过细胞计数试剂盒 -8 (CCK-8) 测定法(目录号:C0038;Beyotime,中国)分析 Nr-CWS 的最佳浓度。在人单核细胞衍生的 DC 诱导培养第 5 天,添加不同浓度的 Nr-CWS(3.75 至 60 µg/ml )。培养2 天后,收获细胞并使用 CCK-8 测定法进行分析。在 Transwell 单元中与 MLR 培养物共培养 2 天后,用 CCK-8 检测 HeLa 细胞的增殖。
2.10 统计分析
数据显示为平均值±SD。统计分析使用SPSS软件25.0版(SPSS公司,美国)进行。统计学意义使用单因素方差分析(ANOVA)或独立样本T检验来评估。显著性表现为P<0.05。
结果
3.1 Nr-CWS促进宫颈组织Th1分化
与正常组相比,感染HPV的患者在宫颈组织中表现出更高的IL-4、IL-17、TGF-β和Foxp3的表达(均为P<0.05)。通过30天的Nr-CWS治疗,这些增加的表达明显减少,90天后减少的更加明显(图1A和B,P<0.05)。在正常组和病例组都发现IFN-γ表达较低。在Nr-CWS治疗30天和90天后,其表达急剧增加(图1A和B,P<0.05)。这些发现表明,Nr-CWS治疗可能通过增强Th1型反应来改善局部免疫反应。测定了宫颈组织中参与T细胞发育的主要转录因子的基因表达。代表Th1细胞的转录因子T-bet在Nr-CWS治疗后在宫颈组织中明显增加。相反,在Nr-CWS治疗后,Th2细胞的GATA3表达、Th17细胞的RORγt表达和Treg细胞的Foxp3表达都减少了(图1C,P<0.05)。
3.2 Nr-CWS促进DC成熟
CCK8检测结果显示,Nr-CWS的最佳浓度为30μg/ml(图2B)。这一浓度被用于进一步的实验中。为了评估Nr-CWS刺激后DCs的改变,我们检查了DCs的形态,评估了DCs成熟的表面标志物,并将DCs与幼稚的CD4+ T细胞共培养,以检查它们吸引T细胞的能力。未刺激的iDCs和LPS刺激的成熟DCs(mDCs)被用作对照。与iDCs相比,Nr-CWS处理导致DCs中成熟标志物CD86、CD83和HLA-DR的表达明显增加,表明Nr-CWS促进DCs的成熟(图2C)。DCs的成熟伴随着大小和突起的增加。暴露在Nr-CWS下的DCs有更大的体积,具有独特的假肢状细胞突起和不平整的表面。LPS诱导的mDCs具有冗长的、毛刺状的细胞突起(图2D)。此外,Nr-CWS处理诱导DCs吸引幼稚的T细胞。在DCs和T细胞的共同培养中,iDCs包括分散的DCs,不能招募T细胞。通过细胞突起连接的幼稚T细胞聚集在Nr-CWS处理的DCs周围。其外观与LPS的效果相当(图2E)。
3.3 Nr-CWS处理的DCs诱导Th1细胞分化,阻碍HeLa细胞增殖
IL-12p70对Th1的激活是必要的 [26]而IL-10作为Th2型细胞因子运作。在本研究中,与iDCs相比,Nr-CWS和LPS增加了IL-12p70,同时减少了DCs中IL-10的产生(图3A,所有P<0.05)。在MLR共培养中,将异体的新生CD4+ T细胞加入到DCs中。收集培养液,用ELISA测定T细胞的分泌。与iDCs相比,Nr-CWS处理导致IL-2和IFN-γ水平明显增加,同时降低了培养基中IL-4和TGF-β的水平(图3B,P<0.05)。相比之下,IL-17a在各组之间没有明显差异。Nr-CWS刺激的DCs显示出明显的诱导Th1分化。在Transwell小室中用DC-T共培养液处理Hela细胞,并通过CCK-8试验测量增殖。与iDC组相比,Nr-CWS组HeLa细胞的增殖被明显抑制(图3C,P<0.05),表明Nr-CWS激活的免疫反应可能抑制了HeLa细胞的增殖。
3.4 Nr-CWS在宫颈组织和DCs中上调FPR3表达
我们以前未发表的来自Nr-CWS治疗后患者宫颈组织的微阵列数据显示,FPR3明显增加,它在DC中独特表达。在本研究中,通过PCR测定,宫颈组织中FPR3的表达明显升高(图4A,P<0.05)。这一发现表明,在Nr-CWS治疗的患者中,FPR3的表达更高。体外研究也得到了类似的结果;与iDCs相比,Nr-CWS导致DCs在mRNA和蛋白水平上的FPR3表达明显增加(图4B,P<0.05)。然而,在LPS诱导的mDCs中没有观察到类似的改变(图4B和C,P>0.05)。因此,Nr-CWS可能通过上调FPR3的表达来实现其效果。
3.5 FPR3参与Nr-CWS诱导的Th1分化
与NC+Nr-CWS 组 相比,沉默FPR3导致siFPR3+Nr-CWS组DC的细胞IL-12产生明显减少(图5A,P<0.05),表明Nr-CWS对DC诱导和T细胞免疫激活的作用主要是由于FPR3的激活。与NC+Nr-CWS组相比,Nr-CWS对IFN-γ和IL-2产生的影响被FPR3敲除后明显减弱(图5B,P<0.05)。然而,FPR3的沉默对Nr-CWS处理的细胞中IL-4、IL-17a和TGF-β的水平没有影响,表明FPR3是参与Nr-CWS诱导的DC中Th1分化的关键因素(图5B)。同样,Nr-CWS对HeLa细胞增殖的抑制在FPR3被敲除的细胞中也受到影响(图5C,P<0.05)。因此,干扰FPR3的激活将阻止Nr-CW处理的DCs使幼稚的CD4+ T细胞向Th1极化,这表明Nr-CWS通过FPR3诱导Th1产生。
讨论
HPV可以通过在局部创造一个免疫抑制的微环境来逃避宿主的免疫监视。HPV是被清除还是持续存在,取决于免疫逃逸机制和宿主免疫反应的互动。 [27].根除HPV感染是防止早期病变发展成宫颈癌的最重要的治疗方法。
Nr-CWS对HPV感染和宫颈病变的临床效果可能是由于其对T细胞的免疫激活作用。 [14].本研究首次探讨了Nr-CWS对HPV感染患者宫颈组织中CD4+ T细胞亚群的影响,发现Th1免疫反应增强。Nr-CWS可能刺激DC成熟并诱导幼稚的CD4+ T细胞向Th1细胞极化。
由CD4+ T细胞发展而来的Th1细胞对于针对HPV的细胞内杀伤性免疫反应至关重要。 [28, 29].研究表明,对HPV感染的宫颈组织的Th1反应较少,但Th2反应增强。 [30, 31].Th17在宫颈发育不良中增加,可能有助于免疫抑制。 [32].Treg细胞的存在与肿瘤的不良预后相关,有助于HPV逃避宿主的免疫监视 [10, 33, 34].在本研究中,Nr-CWS治疗极大地增加了Th1细胞因子IFN-γ的产生,同时降低了宫颈组织中Th2、Th17和Treg相关细胞因子的表达,表明Nr-CWS增强了宫颈组织中抗病毒感染的免疫微环境。
DCs是T细胞免疫的起始触发器。iDCs的迁移很明显,而成熟的DCs则激活幼稚的T细胞,并推动这些细胞发展为效应细胞。 [16, 35]. 细菌成分、炎症细胞因子或抗原-抗体复合物可以促进DCs的成熟。 [36].Nr-CWS是一种源自细菌的提取物,在体外可激活DCs [20].在本研究中,Nr-CWS增强了HLA-DR、CD86和CD83在DCs中的表达,增加了IL-12的产生,并减少了IL-10的产生。IL-10和-12是Th1分化的标志物。此外,我们发现由Nr-CWS激活的DC可以诱导Th1分化,其特征是IFN-γ的分泌。据报道,IFN-γ在HeLa细胞中引起程序性死亡 [37, 38].与HeLa细胞的共培养实验也显示了Nr-CWS导致的生长抑制。
FPR3在骨髓来源的DCs成熟过程中持续表达,并可能通过靶向未知配体调节运输-T细胞免疫刺激阶段的DCs [39]. 在本研究中,Nr-CWS刺激了FPR3在DCs中的表达,并且FPR3参与了Nr-CWS诱导的Th1分化。然而,一些配体可以促进FPR3的激活并阻止LPS诱导的DC成熟和IL-12的分泌 [23].另一项研究报道,致敏性脂质运输蛋白与DC中的FPR3结合,通过释放IL-12和促进IL-10的产生来抑制T细胞。 [24].FPR3的激活导致了Th2型免疫反应。因此,本研究中Nr-CWS刺激的FPR3激活导致了与以前报道的不同类型的免疫力。不同配体激活DC上的FPR3对T细胞的分化方向显示出不同的影响。因此,FPR3在DCs中处理抗原呈递和引导T细胞发育方向可能取决于配体的信号传导。Nr-CWS的肽元素可能是新的FPR3配体,激活IFN主导的抗病毒免疫反应。进一步的研究是必要的,以探索这一建议。
综上所述,Nr-CWS在HPV感染患者的宫颈组织中诱导Th1免疫反应。Nr-CWS可能诱导DC细胞成熟,并通过刺激DC上的FPR3表达来指导Th1细胞分化。这项研究为Nr-CWS对免疫疗法的影响提供了新的证据。
道德声明
所有涉及人类受试者的研究均经河北医科大学第四医院伦理委员会审查批准( 2019MEC097)。所有参与者均获得知情同意。
利益冲突
作者声明,该研究是在没有任何可能被解释为潜在利益冲突的商业或财务关系的情况下进行的。
作者贡献
LZ 和SS对研究的概念和设计做出了贡献。 QG 设计并进行了实验,分析了样本并参与了手稿准备。 WC对实验设计和研究监督做出了贡献。 JS 收集了LRS 室,进行了实验并分析了数据。 CZ 进行了实验并为项目管理做出了贡献。 XB 负责临床患者的招募和治疗。 YZ 和 KL 收集了患者的样本并进行了实验。所有作者都对文章做出了贡献并批准了提交的版本。
资金
这项工作得到了国家重点研发计划(计划编号 2022YFC2704400)和河北省自然科学基金(批准号 H2020206243)的支持。
图示说明
图1 Nr-CWS对宫颈发育不良患者宫颈组织中CD4+ T细胞的影响。(A) 宫颈组织中CD4+ T细胞亚群的代表性免疫组化图像。宫颈样本采集自非HPV患者(正常)、Nr-CWS治疗前的HPV+患者(病例),以及Nr-CWS治疗后30天(Nr-CWS 30D)和90天(Nr-CWS 90D)。通过免疫组织学染色检查IL-4、IFN-γ、IL-17、TGF-β和Foxp3表达。比例尺=20μm。 (B) 宫颈组织中Foxp3、IL-4、IFN-γ、IL-17a、TGF-β和IFN-γ表达的修正H-scores。(C)通过qPCR分析宫颈组织样本中T-bet、GATA3、RORγt和Foxp3的相对mRNA表达(n=35)。*P < 0.01,与正常组相比;# P < 0.01,与病例组相比。
图2 Nr-CWS促进DCs的成熟。(A)体外实验过程的示意图。(B)用不同剂量的Nr-CWS刺激48小时后,用CCK-8测量DC活性。结果是五个独立实验的代表。(C) 通过流式细胞仪测量DC中HLA-DR、CD83和CD86的表达。(D)扫描电子显微镜(SEM)观察DC细胞的形态学改变。(E)光学显微镜(OM)和SEM观察受刺激的DCs对幼稚T细胞的吸引。
图3 Nr-CWS通过DCs诱导Th1型细胞免疫反应。(A) 培养基中IL-12p70和IL-10细胞因子的ELISA数据。(B) 在DC-T细胞共培养的培养基中IL-2、IFN-γ、IL-4、TGF-β和IL-17a细胞因子的ELISA数据。(C) HeLa细胞增殖的CCK-8数据(n=5)。*P < 0.05, **P < 0.001, and ***P < 0.0001, vs iDC.
图4 Nr-CWS上调宫颈组织和DCs中FPR3的表达。(A) 宫颈组织中FPR3 mRNA的表达(n=5)。(B) FPR3 mRNA在DCs中的表达(n=3)。(C) FPR3在DCs中的免疫组织化学染色。(D) 流式细胞仪检测DCs中FPR3的表达。***P< 0.001.
图5 Nr-CWS的影响涉及FPR3的激活。(A) ELISA检测DCs培养基中IL-12p70和IL-10细胞因子的数据。(B) 在DC-T细胞共培养物中IL-2、IFN-γ、IL-4、TGF-β和IL-17a细胞因子的ELISA数据。(C)用Nr-CWS刺激DC后,在与DC和T细胞共培养的培养基中HeLa细胞增殖的CCK-8数据(n=5)。*P < 0.05, ***P < 0.01, vs iDC.NC:阴性对照。
表格
表 1 。 转录因子的正向和反向引物序列

表 2 。患者的临床和人口统计学特征
参考文献
1. Sung, H., J. Ferlay, R.L. Siegel, M. Laversanne, I. Soerjomataram, A. Jemal, et al., Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin, 2021. 71(3): p. 209-249. doi: 10.3322/caac.21660.
2. Schiffman, M., J. Doorbar, N. Wentzensen, S. de Sanjose, C. Fakhry, B.J. Monk, et al., Carcinogenic human papillomavirus infection. Nat Rev Dis Primers, 2016. 2: p. 16086. doi: 10.1038/nrdp.2016.86.
3. Zhu, X. and J. Zhu, CD4 T Helper Cell Subsets and Related Human Immunological Disorders. Int J Mol Sci, 2020. 21(21). doi: 10.3390/ijms21218011.
4. Miossec, P. and J.K. Kolls, Targeting IL-17 and TH17 cells in chronic inflammation. Nat Rev Drug Discov, 2012. 11(10): p. 763-76. doi: 10.1038/nrd3794.
5. Scott, M., M. Nakagawa and A.B. Moscicki, Cell-mediated immune response to human papillomavirus infection. Clin Diagn Lab Immunol, 2001. 8(2): p. 209-20. doi: 10.1128/CDLI.8.2.209-220.2001.
6. Lin, W., Z. Niu, H. Zhang, Y. Kong, Z. Wang, X. Yang, et al., Imbalance of Th1/Th2 and Th17/Treg during the development of uterine cervical cancer. 2019. 12(9): p. 3604.
7. Xue, J., Y. Wang, C. Chen, X. Zhu, H. Zhu and Y. Hu, Effects of Th17 cells and IL-17 in the progression of cervical carcinogenesis with high-risk human papillomavirus infection. Cancer Med, 2018. 7(2): p. 297-306. doi: 10.1002/cam4.1279.
8. Adurthi, S., S. Krishna, G. Mukherjee, U.D. Bafna, U. Devi and R.S. Jayshree, Regulatory T cells in a spectrum of HPV-induced cervical lesions: cervicitis, cervical intraepithelial neoplasia and squamous cell carcinoma. Am J Reprod Immunol, 2008. 60(1): p. 55-65. doi: 10.1111/j.1600-0897.2008.00590.x.
9. Kojima, S., K. Kawana, K. Tomio, A. Yamashita, A. Taguchi, S. Miura, et al., The prevalence of cervical regulatory T cells in HPV-related cervical intraepithelial neoplasia (CIN) correlates inversely with spontaneous regression of CIN. Am J Reprod Immunol, 2013. 69(2): p. 134-41. doi: 10.1111/aji.12030.
10. Vattai, A., N. Kremer, S. Meister, S. Beyer, L. Keilmann, A. Hester, et al., Role of FoxP3-positive regulatory T-cells in regressive and progressive cervical dysplasia. J Cancer Res Clin Oncol, 2022. 148(2): p. 377-386. doi: 10.1007/s00432-021-03838-6.
11. Zhao, J., H. Feng, T. Wang, X. Pang, Y. Zhou and Y. Cui, The safety and efficacy of a novel method for treatment of HSIL. Arch Gynecol Obstet, 2021. 304(5): p. 1291-1298. doi: 10.1007/s00404-021-06047-1.
12. Wang, G., J. Wu, M. Miao, H. Dou, N. Nan, M. Shi, et al., Nocardia rubra cell-wall skeleton promotes CD4(+) T cell activation and drives Th1 immune response. Int J Biol Macromol, 2017. 101: p. 398-407. doi: 10.1016/j.ijbiomac.2017.03.060.
13. Tao, Y., G. Wang, J. Zhai and N. Zhang, Functional modulation of CD8+ T cell by approved novel immune enhancer: Nocardia rubra Cell-Wall Skeletons (Nr-CWS). Int Immunopharmacol, 2020. 78: p. 106023. doi: 10.1016/j.intimp.2019.106023.
14. Chen, W., Y. Zhang, C. Zhao, S. Shao, Y. Zhang, X. Li, et al., Nocardia Rubra Cell Wall Skeleton Up-Regulates T Cell Subsets and Inhibits PD-1/PD-L1 Pathway to Promote Local Immune Status of Patients With High-Risk Human Papillomavirus Infection and Cervical Intraepithelial Neoplasia. Front Immunol, 2020. 11: p. 612547. doi: 10.3389/fimmu.2020.612547.
15. Banchereau, J., F. Briere, C. Caux, J. Davoust, S. Lebecque, Y.J. Liu, et al., Immunobiology of dendritic cells. Annu Rev Immunol, 2000. 18: p. 767-811. doi: 10.1146/annurev.immunol.18.1.767.
16. Schuurhuis, D.H., N. Fu, F. Ossendorp and C.J. Melief, Ins and outs of dendritic cells. Int Arch Allergy Immunol, 2006. 140(1): p. 53-72. doi: 10.1159/000092002.
17. Balan, S., M. Saxena and N. Bhardwaj, Dendritic cell subsets and locations. Int Rev Cell Mol Biol, 2019. 348: p. 1-68. doi: 10.1016/bs.ircmb.2019.07.004.
18. Eisenbarth, S.C., Dendritic cell subsets in T cell programming: location dictates function. Nat Rev Immunol, 2019. 19(2): p. 89-103. doi: 10.1038/s41577-018-0088-1.
19. Meng, Y., J. Sun, X. Wang, Y. Ma, C. Kong, G. Zhang, et al., The biological macromolecule Nocardia rubra cell-wall skeleton as an avenue for cell-based immunotherapy. J Cell Physiol, 2019. doi: 10.1002/jcp.28182.
20. Zhang, S., H. Wang, Y. Liu, T. Tao, Z. Zeng, Y. Zhou, et al., Nocardia rubra cell-wall skeleton influences the development of cervical carcinoma by promoting the antitumor effect of macrophages and dendritic cells. Cancer Med, 2022. 11(5): p. 1249-1268. doi: 10.1002/cam4.4526.
21. Bufe, B., T. Schumann, R. Kappl, I. Bogeski, C. Kummerow, M. Podgorska, et al., Recognition of bacterial signal peptides by mammalian formyl peptide receptors: a new mechanism for sensing pathogens. J Biol Chem, 2015. 290(12): p. 7369-87. doi: 10.1074/jbc.M114.626747.
22. Kim, S.D., J.M. Kim, S.H. Jo, H.Y. Lee, S.Y. Lee, J.W. Shim, et al., Functional expression of formyl peptide receptor family in human NK cells. J Immunol, 2009. 183(9): p. 5511-7. doi: 10.4049/jimmunol.0802986.
23. Kang, H.K., H.Y. Lee, M.K. Kim, K.S. Park, Y.M. Park, J.Y. Kwak, et al., The synthetic peptide Trp-Lys-Tyr-Met-Val-D-Met inhibits human monocyte-derived dendritic cell maturation via formyl peptide receptor and formyl peptide receptor-like 2. J Immunol, 2005. 175(2): p. 685-92. doi: 10.4049/jimmunol.175.2.685.
24. Klaver, D., B. Posch, A. Geisler, M. Hermann, N. Reider and C. Heufler, Peptides from allergenic lipocalins bind to formyl peptide receptor 3 in human dendritic cells to mediate TH2 immunity. J Allergy Clin Immunol, 2020. 145(2): p. 654-665. doi: 10.1016/j.jaci.2019.07.008.
25. Ebner, S., S. Neyer, S. Hofer, W. Nussbaumer, N. Romani and C. Heufler, Generation of large numbers of human dendritic cells from whole blood passaged through leukocyte removal filters: an alternative to standard buffy coats. J Immunol Methods, 2001. 252(1-2): p. 93-104. doi: 10.1016/s0022-1759(01)00337-4.
26. Zhu, J. and W.E. Paul, Peripheral CD4+ T-cell differentiation regulated by networks of cytokines and transcription factors. Immunol Rev, 2010. 238(1): p. 247-62. doi: 10.1111/j.1600-065X.2010.00951.x.
27. Schiffman, M., P.E. Castle, J. Jeronimo, A.C. Rodriguez and S. Wacholder, Human papillomavirus and cervical cancer. The Lancet, 2007. 370(9590): p. 890-907. doi: 10.1016/s0140-6736(07)61416-0.
28. Del Prete, G., Human Th1 and Th2 lymphocytes: their role in the pathophysiology of atopy. Allergy, 1992. 47(5): p. 450-5. doi: 10.1111/j.1398-9995.1992.tb00662.x.
29. Bonecchi, R., G. Bianchi, P.P. Bordignon, D. D'Ambrosio, R. Lang, A. Borsatti, et al., Differential expression of chemokine receptors and chemotactic responsiveness of type 1 T helper cells (Th1s) and Th2s. J Exp Med, 1998. 187(1): p. 129-34. doi: 10.1084/jem.187.1.129.
30. Kobayashi, A., V. Weinberg, T. Darragh and K. Smith-McCune, Evolving immunosuppressive microenvironment during human cervical carcinogenesis. Mucosal Immunol, 2008. 1(5): p. 412-20. doi: 10.1038/mi.2008.33.
31. Scott, M.E., Y. Ma, L. Kuzmich and A.B. Moscicki, Diminished IFN-gamma and IL-10 and elevated Foxp3 mRNA expression in the cervix are associated with CIN 2 or 3. Int J Cancer, 2009. 124(6): p. 1379-83. doi: 10.1002/ijc.24117.
32. Gosmann, C., S.R. Mattarollo, J.A. Bridge, I.H. Frazer and A. Blumenthal, IL-17 suppresses immune effector functions in human papillomavirus-associated epithelial hyperplasia. J Immunol, 2014. 193(5): p. 2248-57. doi: 10.4049/jimmunol.1400216.
33. Ohue, Y. and H. Nishikawa, Regulatory T (Treg) cells in cancer: Can Treg cells be a new therapeutic target? Cancer Sci, 2019. 110(7): p. 2080-2089. doi: 10.1111/cas.14069.
34. Molling, J.W., T.D. de Gruijl, J. Glim, M. Moreno, L. Rozendaal, C.J. Meijer, et al., CD4(+)CD25hi regulatory T-cell frequency correlates with persistence of human papillomavirus type 16 and T helper cell responses in patients with cervical intraepithelial neoplasia. Int J Cancer, 2007. 121(8): p. 1749-55. doi: 10.1002/ijc.22894.
35. Cignetti, A., A. Vallario, I. Roato, P. Circosta, B. Allione, L. Casorzo, et al., Leukemia-derived immature dendritic cells differentiate into functionally competent mature dendritic cells that efficiently stimulate T cell responses. J Immunol, 2004. 173(4): p. 2855-65. doi: 10.4049/jimmunol.173.4.2855.
36. Song, L., G. Dong, L. Guo and D.T. Graves, The function of dendritic cells in modulating the host response. Mol Oral Microbiol, 2018. 33(1): p. 13-21. doi: 10.1111/omi.12195.
37. Li, J., Y. Zhang, L. Chen, X. Lu, Z. Li, Y. Xue, et al., Cervical Cancer HeLa Cell Autocrine Apoptosis Induced by Coimmobilized IFN-gamma plus TNF-alpha Biomaterials. ACS Appl Mater Interfaces, 2018. 10(10): p. 8451-8464. doi: 10.1021/acsami.7b18277.
38. Guan, Y.Q., Z. Li and J.M. Liu, Death signal transduction induced by co-immobilized TNF-alpha plus IFN-gamma and the development of polymeric anti-cancer drugs. Biomaterials, 2010. 31(34): p. 9074-85. doi: 10.1016/j.biomaterials.2010.08.044.
39. Yang, D., Q. Chen, B. Gertz, R. He, M. Phulsuksombati, R.D. Ye, et al., Human dendritic cells express functional formyl peptide receptor‐like‐2 (FPRL2) throughout maturation. 2002. 72(3): p. 598-607. doi: 10.1189/jlb.72.3.598.
